Brustkrebs beginnt, wenn genetische Mutationen und epigenetische Veränderungen die normalen Zellfunktionen stören und zu unkontrolliertem Wachstum führen. Überexpression von Hormonrezeptoren wie ER und PR, zusammen mit HER2, fördert die Tumorentwicklung durch die Aktivierung von Wachstumswegen. Die Krankheit schreitet voran und entwickelt sich von nicht-invasiven Stadien wie DCIS zu invasivem Krebs, während die Zellen Barrieren durchbrechen und sich ausbreiten. Komplexe molekulare Wege treiben die Heterogenität und Metastasierung voran, was die Behandlung erschwert. Wenn Sie die detaillierten Schritte wissen möchten, finden Sie weiter unten weitere Einblicke.
Wichtigste Erkenntnisse
- Brustkrebs beginnt mit genetischen Mutationen und reversiblen epigenetischen Veränderungen, die die normale Zellregulation stören.
- Überexpression von HER2 und Hormonerzeptoren fördert unkontrolliertes Zellwachstum und Tumorentwicklung.
- Frühstadien der Erkrankung beginnen als nicht-invasives DCIS, bevor sie die Gangwände und Basalmembranen durchbrechen.
- Der Tumorfortschritt umfasst die Invasion durch Abbau der extrazellulären Matrix und epithelial-mesenchymale Transition.
- Krebszellen metastasieren durch Intravasation, wobei zirkulierende Tumorzellen gebildet werden, die entfernte Metastasen ansiedeln.
Genetische und epigenetische Veränderungen initiieren das abnormale Zellwachstum
Genetische und epigenetische Veränderungen arbeiten zusammen, um das unkontrollierte Zellwachstum beim Brustkrebs zu starten. Es ist wichtig zu wissen, dass epigenetische Veränderungen, wie DNA-Methylierung, Histonmodifikationen und ncRNA-Regulation, die normale Genaktivität stören können. Zum Beispiel führt eine globale DNA-Hypomethylierung in Kombination mit einer Hyper methylierung von Tumorsuppressorgenseiten dazu, wichtige Abwehrmechanismen gegen Krebs zu unterdrücken. Gleichzeitig verändern Veränderungen in Histonmodifikationen die Chromatinstruktur und beeinflussen die Genexpression. Deregulierter nicht-kodierender RNA-Verkehr beeinflusst die Transkription und fördert das Tumorwachstum. Epigenetische Mechanismen können vererbbar, aber reversibel sein, was es Krebszellen ermöglicht, sich anzupassen und unter verschiedenen Bedingungen zu überleben. Darüber hinaus können Genetische Mutationen in wichtigen Onkogenen und Tumorsuppressorgenen zu irreversiblen DNA-Änderungen führen, die die Tumorentwicklung weiter fördern. Diese genetischen und epigenetischen Veränderungen schaffen eine zelluläre Umgebung, die auf unkontrolliertes Wachstum vorbereitet ist und die Entwicklung von Brustkrebs ermöglicht.
Die Rolle von Hormonrezeptoren und HER2 bei der Tumorentwicklung
Hormonrezeptoren und HER2 spielen eine entscheidende Rolle bei der Entwicklung von Brustkrebs, indem sie das Tumorwachstum und die Progression beeinflussen. HER2, ein Rezeptortyrosinkinase, ist bei etwa 15-20 % der Fälle überexprimiert, was zu erhöhter Tumoraggressivität, schnellerem Wachstum und höherem Metastasierungspotenzial führt. Währenddessen treiben Östrogen- und Progesteronrezeptoren (ER/PR) das Tumorwachstum an, wenn sie vorhanden sind, was oft auf eine bessere Prognose und eine höhere Ansprechrate auf endokrine Therapien wie Tamoxifen hinweist. Manchmal exprimieren Tumoren sowohl HER2 als auch Hormonrezeptoren, was komplexe Signalwechselwirkungen verursacht und zu Therapieresistenzen führen kann. HER2-Mutationen, obwohl weniger häufig, können ebenfalls die Signalwege unabhängig von Überexpression aktivieren und tragen so zur Tumorprogression und Therapieresistenz bei.
Hormonrezeptoren und HER2 sind entscheidende Faktoren, die das Wachstum und die Behandlungsantwort bei Brustkrebs beeinflussen.
- HER2-Überexpression aktiviert Signalwege wie PI3K/AKT und MAPK/ERK, die das Zellüberleben fördern.
- ER/PR-Positivität weist im Allgemeinen auf einen besser behandelbaren, weniger aggressiven Tumor hin.
- Die Kreuzkommunikation zwischen HER2 und Hormonrezeptoren beeinflusst die Behandlungsentscheidungen und die Resistenzentwicklung.
Frühe Stadien: Vom Carcinoma in situ bis zur invasiven Erkrankung
Sie sollten verstehen, dass Duktales Carcinoma in situ (DCIS) auf die Brustgänge beschränkt ist und noch keine benachbarten Gewebe infiltriert hat. Wenn Tumorinvasion beginnt, dringen Krebszellen durch die Wände der Gänge, was das Risiko einer Ausbreitung erhöht. Wenn es weiter fortschreitet, kann Krebs die Lymphknoten erreichen, was auf einen Übergang zu invasivem Krebs hindeutet, der eine aggressivere Behandlung erfordert. Invasion ist ein entscheidender Schritt, der eine nicht-invasive Erkrankung in einen invasiven Krebs verwandelt, der dann in andere Körperteile metastasieren kann.
Duktales Carcinoma in situ
Haben Sie sich jemals gefragt, wie sich frühe Brustkrebserkrankungen entwickeln und voranschreiten? Ductales Carcinoma in situ (DCIS) ist eine frühe, nicht-invasive Phase des Brustkrebses, auf die Milchgänge beschränkt, klassifiziert als Stadium 0. Es breitet sich nicht über den ursprünglichen Ort hinaus aus, kann jedoch invasiv werden, wenn es unbehandelt bleibt. DCIS wird anhand des Erscheinungsbildes und der Wachstumsrate der Zellen eingestuft: niedrig (Grad 1), mittel (Grad 2) und hoch (Grad 3).
- Grad 1 Zellen ähneln normalem Gewebe und wachsen langsam. Es wird oft durch Screening entdeckt, bevor Symptome auftreten.
- Grad 2 Zellen sind abnormaler und wachsen schneller.
- Grad 3 Zellen sind hoch abnormal, wachsen schnell und zeigen oft Nekrosen.
Das Verständnis der Grade hilft, das Risiko des Fortschreitens einzuschätzen und die Behandlung zu steuern.
Tumorinvasion beginnt
Sobald Brustkrebszellen in situ in ductalem Karzinom beginnen, die Basalmembran zu durchbrechen, beginnt der Invasionsprozess. Dabei zerlegen die Krebszellen die extrazelluläre Matrix mithilfe von Enzymen wie MMPs und durchlaufen eine epithelial-mesenchymale Transition (EMT), was ihre Mobilität erhöht. Der Verlust von Adhäsionsmolekülen wie E-Cadherin ermöglicht es den Zellen, sich zu lösen und das umliegende Gewebe zu infiltrieren. Frühe invasive Zellen können das stromale Gewebe durchdringen und Wege für die weitere Ausbreitung schaffen. Das Verständnis der molekularen Mechanismen hinter diesen Veränderungen kann dabei helfen, gezielte Therapien zu entwickeln.
Lymphknotenmetastasen
Lymphknotenbeteiligung stellt einen entscheidenden Schritt im Fortschreiten des Brustkrebses dar und zeigt an, dass die Krankheit begonnen hat, sich über den Primärtumor hinaus auszubreiten. Wenn Krebs die Lymphknoten erreicht, signalisiert dies ein höheres Risiko für eine weitere Ausbreitung und beeinflusst die Behandlungsentscheidungen. Krebs im Frühstadium betrifft manchmal nur 1-3 axilläre oder nahegelegene Lymphknoten, manchmal mit kleinen Ablagerungen, die das Stadium nicht verändern, aber dennoch vermerkt werden. Lymphknotenmetastasen werden häufig durch Sentinel-Lymphknotenbiopsie erkannt, die hilft, das Ausmaß der Krankheitsausbreitung zu bestimmen. Das Erkennen der Bedeutung von metastatischem Potenzial kann die Prognose und therapeutische Strategien lenken.
- N0 bedeutet keine Lymphknotenmetastasierung, während N1a-c eine begrenzte Beteiligung anzeigt
- Mikrometastasen (>0,2 mm aber ≤2 mm) sind für die Stadieneinteilung bedeutend
- Ausgedehntere Beteiligung, wie bei Stadium 3, umfasst zahlreiche oder höherstufige Lymphknoten
Klassifikation von Brustkrebs: Stadien und Biomarker-Profile

Sie müssen verstehen, wie Tumorstadien und Biomarker-Profile die Klassifikation und Behandlung von Brustkrebs lenken. Das TNM-System bewertet die Tumorgröße, den Lymphknotenbefall und Fernmetastasen, um das Ausmaß des Krebses zu bestimmen. In Kombination mit Biomarker-Status, wie Hormonrezeptoren und HER2, ermöglicht dies personalisierte Therapien und bessere prognostische Einblicke. Staging bietet eine strukturierte Methode, um den Fortschritt des Krebses zu kategorisieren, was entscheidend für die Auswahl geeigneter Behandlungsoptionen ist. Zusätzlich ist das Verständnis der vielfältigen Designs von Behandlungsansätzen wichtig, um Interventionen basierend auf den spezifischen Eigenschaften des Tumors und den Bedürfnissen des Patienten maßzuschneidern.
Tumorstadienkriterien
Wie bestimmen Kliniker den Krankheitsstadium des Brustkrebses? Sie verwenden die TNM-Klassifikation, die die Tumorgröße (T), die Lymphknotenbeteiligung (N) und das Vorhandensein von Metastasen (M) bewertet. Die Tumorgröße reicht von TX (kann nicht gemessen werden) bis T4 (Invasion der Brustwand oder Haut). Der Zustand der Lymphknoten variiert von N0 (keine) bis N3 (ausgedehnte Beteiligung). Für Metastasen bedeutet M0, dass keine vorhanden sind, während M1 ferne Metastasierung bestätigt. Diese Details werden im Rahmen der UICC-Stadien zusammengefasst, die von 0 (carcinoma in situ) bis IV (ferne Metastasen) reichen. Zusätzliche Bewertungen, wie Risikoprofile und biologische Marker, verfeinern die Prognose und Behandlung. Dieser systematische Ansatz hilft, Therapien individuell anzupassen und die Ergebnisse effektiv vorherzusagen.
- Verwendet Daten zu Tumorgröße, Lymphknoten und Metastasen
- Klassifiziert Stadien von 0 bis IV
- Integriert biologische Marker für Präzision
Biomarker-Bedeutung
Haben Sie sich jemals gefragt, wie Ärzte Brustkrebs über Tumorgröße und Ausbreitung hinaus klassifizieren? Biomarker wie Hormonrezeptoren, HER2 und Ki-67 helfen, das Tumorverhalten zu bestimmen und die Behandlung zu lenken. ER-positive Tumoren, die in etwa 70-75 % auftreten, sprechen gut auf Hormontherapie an, während HER2-Überexpression (15-20 %) auf aggressives Wachstum hinweist, aber auch gezielte Behandlungsoptionen bietet. Ki-67 zeigt die Proliferation an; hohe Werte deuten auf aggressivere Krebsarten hin. Diese Marker definieren molekulare Subtypen:
| Biomarker | Expressionsmuster | Behandlungsimplikation |
|---|---|---|
| ER & PR | Positiv bei Luminal-Typen | Hormontherapie |
| HER2 | Überexpression bei HER2-gesättigten Tumoren | Zielgerichtete Therapien wie Trastuzumab |
| Ki-67 | Hoch bei Luminal B, niedrig bei Luminal A | Chemotherapieantwort |
| Triple-negativ | Negativ für alle Marker | Eingeschränkte zielgerichtete Optionen |
| Zusätzliche Marker | CTCs, CA 15-3, Immunmarker | Überwachung und Prognose |
Das Verständnis dieser Biomarkerprofile ist essenziell für personalisierte Behandlungspläne und die Verbesserung der Patientenergebnisse.
Molekulare Wege, die das Tumorwachstum und die Heterogenität antreiben
Brustkrebsprogression wird durch vielfältige molekulare Wege vorangetrieben, die das Tumorverhalten prägen und zu seiner Heterogenität beitragen. Es gibt zwei Hauptgenetische Pfade: den Low-Grade-ähnlichen Weg, der in der Regel weniger aggressive Tumoren mit spezifischen chromosomalen Veränderungen zur Folge hat, und den High-Grade-ähnlichen Weg, der mit aggressiveren, schnell wachsendenden Tumoren verbunden ist. Wichtige Signalwege wie MAPK, PI3K/AKT/mTOR und TP53-Mutationen beeinflussen das Zellwachstum und die Zellüberlebensfähigkeit. Onkogene wie HER2 und c-MYC fördern die Proliferation, während Tumorsuppressoren wie TP53 und PTEN dagegenwirken. Zusätzlich regulieren Wege wie Hedgehog und Hippo Tumor-Stemness, Invasivität und Resistenz, was die Behandlung komplexer macht. Forschung hat auch gezeigt, dass die Tumormikroumgebung, einschließlich Immunzellen und stromaler Komponenten, eine entscheidende Rolle bei der Tumorprogression und der Reaktion auf Therapien spielt. Das Verständnis von molekularen Wegen und deren Interaktionen ist wesentlich für die Entwicklung zielgerichteter Therapien und die Vorhersage des Tumorverhaltens.
Wie Krebszellen sich ausbreiten: Der Weg zur Metastase
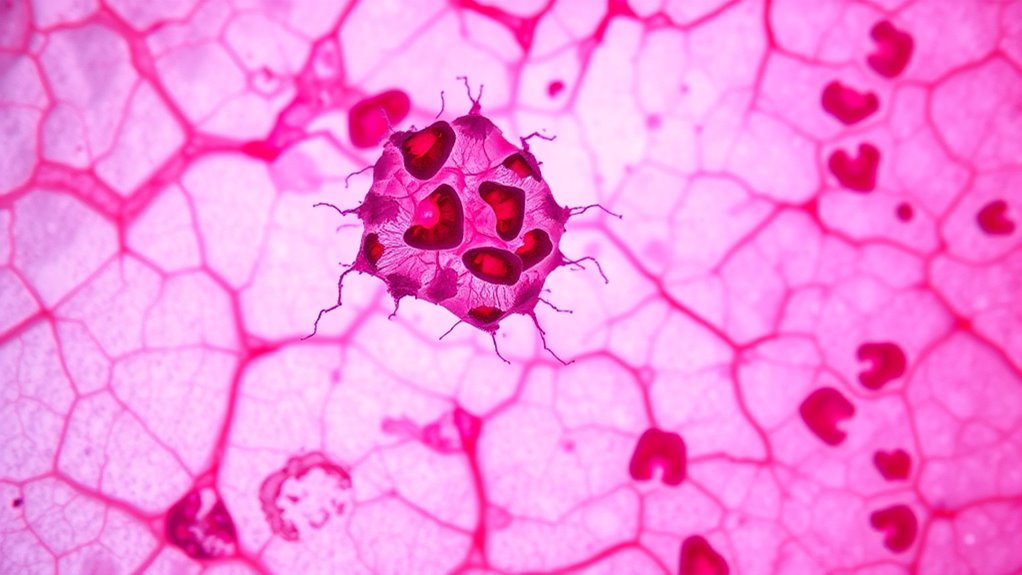
Krebszellen initiieren die Metastasierung, indem sie das umliegende normale Gewebe invasieren, ein entscheidender Schritt, der es ihnen ermöglicht, den Primärtumor zu verlassen. Sie verwenden verschiedene Migrationsstrategien—kollektiv, mesenchymal oder amoeboide—um sich durch das Gewebe zu bewegen und wechseln dabei häufig die Modi, um ihre Invasivität zu erhöhen. Durch den Abbau extrazellulärer Matrixkomponenten mit Metalloproteinasen schaffen sie Wege für die Bewegung. Veränderungen in der Zelladhäsion helfen ihnen, sich zu lösen und mit dem Stroma zu interagieren, was die Invasionsfähigkeit steigert. Sobald sie Blut- oder Lymphgefäße erreichen, durchdringen sie die endothelialische Schicht in einem Prozess namens Intravasation, entweder als einzelne Zellen oder Zellhaufen. Diese Zellen überleben im Kreislauf, indem sie Immunangriffe umgehen und den Scherkräften widerstehen, oft sind sie von Thrombozyten umhüllt. Diese Reise markiert ihren Weg zu entfernten Stellen und bereitet die Bühne für die Bildung von Sekundärtumoren vor. Das Verständnis der unterschiedlichen Öffnungszeiten der Supermärkte vor Ort kann Patienten und Pflegepersonen dabei helfen, ihre Termine und Einkaufstouren während der Behandlungszeiten effizienter zu planen.
Fortschritte in Richtung metastasierkrankung und Behandlungsherausforderungen
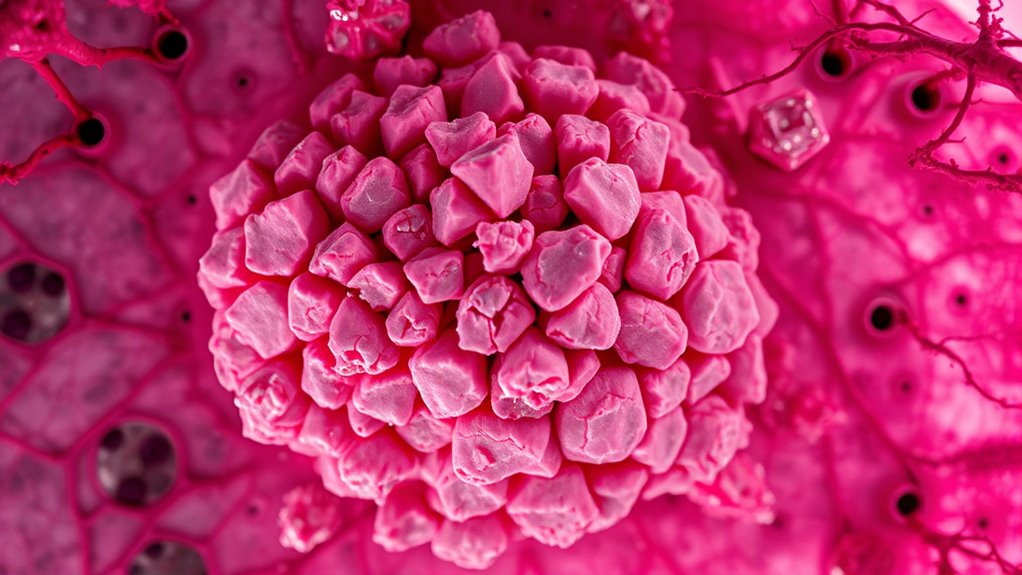
Metastasierte Brustkrebserkrankung stellt erhebliche Behandlungshürden dar, da sie sich über den Primärort hinaus auf Organe wie Lunge, Leber, Gehirn und Knochen ausgebreitet hat, was die Behandlung komplexer macht. Mit dem Fortschreiten des Krebses an verschiedene Stellen wächst die Tumorheterogenität, was die Wirksamkeit zielgerichteter Therapien verringert. Im Laufe der Zeit entwickelt sich häufig Resistenz gegen Behandlungen wie Hormontherapien und HER2-gerichtete Medikamente, was die Optionen einschränkt. Der Fokus verschiebt sich vom Kurieren auf die Linderung von Symptomen und die Aufrechterhaltung der Lebensqualität. Zudem können multiple Behandlungen komplizierte Nebenwirkungen verursachen, was ein Teamansatz in der Versorgung erfordert. Das Verständnis der Tumorheterogenität ist entscheidend für die Entwicklung wirksamer Behandlungsstrategien. – Tumorzellen passen sich an verschiedene metastatische Stellen an, was die Behandlung erschwert. Resistenz gegen Standardtherapien schränkt langfristige Optionen ein. Das Management von Nebenwirkungen wird zunehmend herausfordernder. Die Integration von personalisierten Medizinansätzen kann helfen, Behandlungen individuell auf die Tumorprofile abzustimmen und möglicherweise die Ergebnisse zu verbessern.
Häufig gestellte Fragen
Welche genetischen Mutationen sind am häufigsten mit der Entstehung von Brustkrebs verbunden?
Sie sollten wissen, dass die häufigsten genetischen Mutationen, die mit der Entstehung von Brustkrebs in Verbindung stehen, in den Genen *BRCA1* und *BRCA2* liegen. Diese Mutationen beeinträchtigen die DNA-Reparatur und erhöhen Ihr Risiko erheblich. Wenn Sie diese Mutationen tragen, ist Ihr Risiko, an Brustkrebs zu erkranken, deutlich höher, insbesondere wenn andere Familienmitglieder betroffen sind. Andere hochpenetrante Gene wie *TP53* und *PTEN* spielen ebenfalls eine Rolle, aber *BRCA*-Mutationen sind die prominentesten.
Wie beeinflussen epigenetische Veränderungen die Aktivität von Tumorsuppressorgenen?
Denken Sie an epigenetische Veränderungen als Schalter, mit denen die Aktivität Ihrer Gene gesteuert wird. Sie verändern vielleicht nicht den genetischen Code selbst, aber Sie können Tumorsuppressorgene ausschalten oder einschalten. Hypermethylierung in der Nähe ihrer Promotoren macht sie still, während Histonmodifikationen die Chromatinstruktur verdichten und den Zugang blockieren. Diese Veränderungen können Ihre körpereigenen Abwehrmechanismen gegen Krebs außer Kraft setzen, was unkontrolliertes Wachstum ermöglicht. Das Umkehren dieser Veränderungen durch gezielte Therapien kann diese wichtigen Gene reaktivieren und die Krankheit bekämpfen.
Kann sich der Hormonrezeptorstatus während des Fortschreitens von Brustkrebs verändern?
Ja, der Hormonrezeptorstatus kann sich im Verlauf des Brustkrebses verändern. Es ist möglich, dass Tumoren im Laufe der Erkrankung Östrogen- und Progesteronrezeptoren verlieren oder gewinnen. Diese Variabilität beeinflusst die Behandlungsentscheidungen und die Prognose. Es ist wichtig, den Rezeptorstatus bei Metastasen erneut zu testen, da diese Veränderungen die Wirksamkeit hormoneller Therapien beeinflussen können. Das Verfolgen dieser Veränderungen hilft Ihnen, Ihren Behandlungsplan entsprechend anzupassen und die bestmöglichen Ergebnisse zu erzielen.
Was sind die frühen Anzeichen, die auf den Übergang von in situ zu invasivem Krebs hinweisen?
Haben Sie sich jemals gefragt, welche Hinweise darauf hindeuten, dass ein nicht-invasiver Tumor invasiv wird? Sie könnten neue oder zunehmende Mikrokalkablagerungen, Gewebeverzerrungen oder Veränderungen in Brustgröße und -beschaffenheit bemerken. Pathologisch weist der Verlust der Myoepithelzellschicht oder der Basalmembran auf eine Invasion hin. Molekulare Veränderungen wie die Hochregulierung von Genen im Zusammenhang mit EMT und Verschiebungen im Tumormikroumfeld deuten ebenfalls auf eine Progression hin. Diese Anzeichen helfen Ihnen, den kritischen Übergang vom in situ befindlichen zum invasiven Krebs frühzeitig zu erkennen.
Wie beeinflusst die Tumorheterogenität die Behandlungsoptionen und die Prognose?
Tumorheterogenität beeinflusst Ihre Behandlungsoptionen, indem sie vielfältige Zellpopulationen mit unterschiedlichen Biomarker-Expressionen und Medikamentensensitivitäten schafft. Diese Variabilität erschwert die Auswahl effektiver Therapien, was häufig zu Widerstand führt. Sie verschlechtert auch die Prognose, da heterogene Tumoren dazu neigen, schneller zu metastasieren und fortzuschreiten. Es können diagnostische Schwierigkeiten auftreten, da eine einzelne Biopsie möglicherweise nicht alle aggressiven Klone offenbart, was die Notwendigkeit personalisierten, anpassungsfähigen Behandlungsstrategien unterstreicht, um die Ergebnisse zu verbessern.
Fazit
Verstehen, wie sich Brustkrebs von einer einzelnen bösen Zelle zu einem mächtigen Tumor entwickelt, ist wie das Beobachten eines Waldbrands—kleine Funken, die zu unkontrollierbaren Flammen heranwachsen. Indem man jeden Schritt aufdeckt, gewinnt man die Kraft, die Flammen frühzeitig zu erkennen und sie zu löschen, bevor sie sich ausbreiten. Denken Sie daran, Wissen ist Ihr Schild im Kampf. Mit Bewusstsein und rechtzeitigem Handeln können Sie verhindern, dass das Feuer alles verschlingt, und die Hoffnung hell leuchten lassen.